Fjerning av protein N-terminal acetylering gir degradering av ribosomale proteiner
Rollen til den mest vanlige proteinmodifiseringen, N-terminal acetylering, har vært et mysterium helt siden dets oppdagelse. En UiB-artikkel kaster nytt lys på dette.

Hovedinnhold
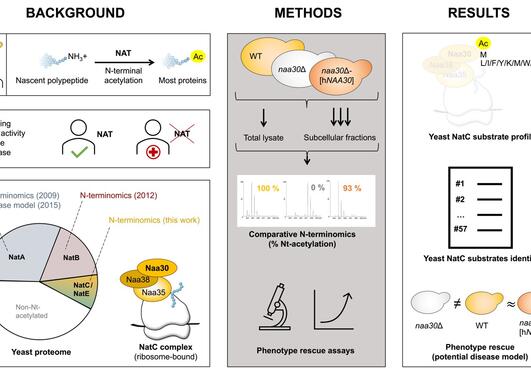
Sammen med samarbeidspartnere ved Universitetet i København har Arnesen laboratoriet ved UiB undersøkt cellulære proteiners stabilitet med og uten tilstedeværelse av N-terminal acetylering. Det ble brukt gjærceller som manglet den viktigste N-terminale acetyltransferasen NatA for å kunne studere celler som manglet halvparten av alle N-terminale acetyleringer. NatA er koblet til medfødt sykdom og kreft, og våre funn kan være relevante for forståelsen av sykdomsmekanismer og behandling. Gjæren Saccharomyces cerevisiae er en enkel eukaryot modellorganisme og dens nytte er her igjen bevist. Siden genene som koder for det humane NatA komplekset er essensielle for overlevelse av menneskeceller er det ikke mulig å gjøre en slik studie med slike celler. Siden den biokjemiske funksjonen av NatA (og mange andre proteiner) er konservert fra gjær til menneske, kan vi lære mye av å utforske denne enkle organismen.
Etter å ha isotopmerket alle proteinene I gjærcellene, ble en rekke prøver høstet ved bestemte tidsintervaller. Henriette Aksnes, Nina Glomnes og mange flere medlemmer av Arnesen laboratoriet tilbrakte sene kvelder i laboratoriet for å dyrke gjær og prosessere alle de nødvendige prøvene. Dette muliggjorde analyser i København for å globalt monitorere levetiden til gjærens proteiner, og det ble funnet at gjær som mangler NatA har en økt turnover av bestemte proteiner – spesifikt de som utgjør deler av ribosomet (cellens proteinfabrikk). Disse funnene foreslår at N-terminal acetylering har en rolle i å fremme proteinstabilitet ved å bidra til å bedre protein-protein interaksjoner og folding.
I mennesker kan mutasjoner i genene som koder for NatA komplekset gi medfødt hjertesykdom. Det ble oppdaget at slike NatA-muterte menneskeceller hadde endringer i ribosomale proteiner. De nye funnene fra gjærmodellen kan derfor belyse sykdomsmekanismene i disse pasientene til å involvere økt turnover av ribosomale proteiner og redusert ribosomal stabilitet.
Studien er støttet av det Europeiske forskningsrådet ERC, EPIC-XS, Kreftforeningen og Helse Vest. Rasmus Ree ble støttet av det Medisinske fakultet UiB for å besøke Jesper Olsen laboratoriet ved Universitetet i København.