Bedre forståelse av oksygensensor i menneskeceller
Oksygen er livsviktig for mennesker og det er nødvendig at cellene våre kan respondere på lave oksygennivåer. Forskere ved Universitetet i Oxford og Universitetet i Bergen har avdekket nye faktorer som definerer hvordan menneskeceller responderer på lave oksygennivåer.

Hovedinnhold
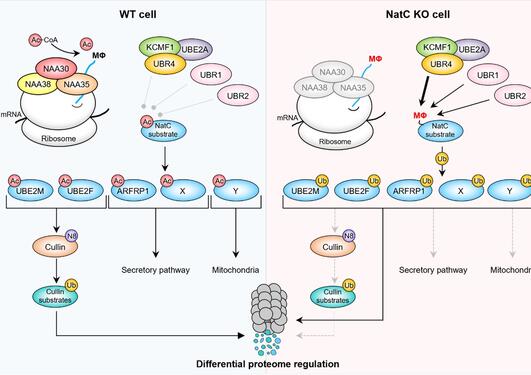
En av de viktigste mekanismene hos mennesker for oksygen-mediert regulering skjer via transkripsjonsfaktorer kalt hypoxia inducible factors (HIFs). For 5 år siden fant imidlertid forskere ved Universitetet i Oxford en ny nøkkelsensor for oksygen i humane celler: det humane ADO enzymet (2-Aminoethanethiol dioxygenase eller cysteamine dioxygenase) (Science, 2019). ADO regulerer stabiliteten til proteiner på en O2-avhengig måte via oksidering av Cystein-startende proteiner som fører til deres cellulære degradering. ADO-mediert kontroll av proteinstabilitet har derfor potensiale til å være en viktig regulator av fysiologiske responser til hypoksi, spesielt for å gi en rask respons sammenlignet med HIF-systemet som gir en hypoksi-adapsjon via økt genekspresjon.
Tre proteinsubstrater av ADO er tidligere definerte: regulatorer av G-proteinsignalering (RGS4/5) og kjemokin interleukin 32 (IL32), hvor degradering både styres av ADO og oksygen. Det er imidlertid 200-300 forskjellige humane proteiner som starter med aminosyren Cystein (dvs at Cystein er på N-terminal ende av proteinet etter at Metionin er kløyvet fra, noe som skjer mens proteinet produseres). Alle disse er potensielle ADO substrater som kan reguleres ved hypoksi. Spørsmålet er derfor hvor mange og hvilke proteiner som er substrater av ADO og dermed potensielt involvert i en cellulær hypoksirespons.
Forskningsgruppene til Emily Flashman og Peter Ratcliffe (Universitetet i Oxford) analyserte et stort antall forskjellige Cystein-startende proteiner in vitro og i humane celler. ADO modifiserte proteiner med bestemte aminosyrer i posisjonen etter Cystein (basiske og aromatiske aminosyrer). Noe som var påfallende var at flere proteiner som var gode substrater for ADO i reagensrør ikke var regulert av ADO i humane celler, noe som kunne peke på at deres N-terminale ende var beskyttet mot oksidering i celler. En mulig forklaring kunne være at disse proteinene var modifisert av andre kjemiske grupper. Den mest vanlige formen for proteinmodifisering på N-terminal ende av proteiner er N-terminal acetylering.
Basert på mange års forskning på denne proteinmodifiseringen og dens ansvarlige enzymer, ble forskningsgruppen til Thomas Arnesen ved Institutt for Biomedisin, UiB, koblet inn i denne forskningen. UiB forskeren Matti Myllykoski, PhD-student Malin Lundekvam og postdoktor Nina McTiernan utførte en rekke eksperimenter med rensede enzymer, syntetiske peptider, humane celler og den klassiske modellorganismen gjær (Saccharomyces cerevisiae). Konklusjonen var klar: Proteiner som starter med Cystein kan bli N-terminal acetylert av et enzym kalt NatA. Det ble videre funnet at NatA foretrekker helt andre Cystein-startende proteiner enn ADO. NatA sin substratspesifisitet er rettet mot Cystein når denne er etterfulgt av sure eller polare aminosyrer. Til tross for disse motsatte preferansene hos ADO og NatA, så er det noen proteiner med intermediære N-terminale sekvenser som er potensielle substrater for både ADO og NatA. Imidlertid avslørte videre eksperimenter at N-terminal acetylering og N-terminal oksidering ikke kan skje på samme N-terminale ende (på samme protein) til tross for at de er koblet til ulike reaktive grupper (acetylering av amino-gruppe og oksidering av tiol-gruppe).
Disse forsøkene avslørte at NatA og ADO i hovedsak har utviklet seg til å modifisere forskjellige grupper av Cystein-startende cellulære proteiner. ADO substratene blir degradert ved normale oksygennivåer mens NatA substratene er stabile. Proteinene som potensielt blir modifisert av enten ADO eller NatA (intermediære sekvenser) kan trolig bli degradert via ADO ved normale oksygennivåer ved tilstander der NatA aktivitet er redusert som ved stress eller sykdom.
Totalt sett har denne studien bidratt til å definere hvilke cellulære proteiner som er tilgjengelige for ADO- og oksygen-avhengig regulering, og fremmer dermed vår forståelse av hvordan oksygennivå påvirker humane celler.
Artikkelen kan leses her.